ピルビン酸キナーゼ, pyruvate kinase, PK
7-24-2016 updated
- 概要: ピルビン酸キナーゼとは
- アイソフォーム
- 活性調節
概要: ピルビン酸キナーゼとは
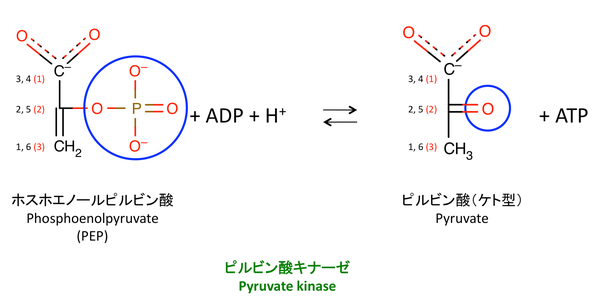
ピルビン酸キナーゼとは,解糖 glycolysis の最後(10 番目)の反応を触媒する酵素である。ホスホエノールピルビン酸からリン酸基を除去し,ピルビン酸イオン pyruvate を作る。「キナーゼ」は一般にリン酸化酵素であるので,この反応は逆反応である。
アイソフォーム
> 哺乳類には,L, R. M1, M2 の 4 つの PK isoform が存在する(1I)。
: L および R は,肝臓および赤血球でそれぞれ発現する。
: M は最初に筋肉で発見され,M1 と M2 がある。M1 はほとんどの成体組織で発現する。
: M2 は PKM1 の splicing variant である。1 つ exon が多い。発生段階で発現し,ガン細胞とも関係する。
> PKM2 は F1,6-BP との結合サイトを含む(2I)。
: PKM2 は low activity enzyme で,F1,6-BP による allosteric activation に依存する。
: PKM2 は 4 量体で活性型,2 量体で不活性型(2I)。
: PKM1 は constitutively active である(1D, 2I)。
> PKM2 はガン細胞で排他的に発現し,ワーバーグ効果の機構の一つであると考えられている(1R)。
: PKM1 の多い細胞では酸化的リン酸化が活発である。PKM2 が増えると aerobic glycolysis の割合が増える。
: しかし,これに反する報告もある。詳細はワーバーグ効果のページを参照。
> PKM2 は glycolysis 以外の機能ももっている(1D)。
: Caspase-independent cell death.
: Tyr-phosphorylated proteins と相互作用する。
> PKL は glucagon-cAMP 系によるリン酸化制御を受ける(3)。
活性調節
PK はヘキソキナーゼ hexokinase,ホスホフルクトキナーゼ phosphofructokinase とともに解糖系の律速酵素の一つである(3)。
ATP
> エネルギーが余っているときに解糖系が動き続けるのを防ぐ意味があると考えられる(3)。
Fructose-1,6-biphosphate
> PFK による反応生成物。PFK の活性が高いとき,PK がそれに応じて活性化する仕組みになっている。
: ヘキソキナーゼも,このような形で PFK の活性変化を追随する。PFK が主要律速酵素と言われる理由。
Alanine
アラニン Ala は単純な構造のアミノ酸であり,ピルビン酸 + アミノ基 の反応で合成される。筋肉がエネルギー不足に陥り,アミノ酸を分解しているときに余ったアミノ基がこのように処理される(3)。したがって,筋肉のアラニン合成は,炭素骨格が十分に存在し,むしろ糖新生が必要な状態であり,解糖は不要というシグナルであるらしい。
References
- Christofk et al. 2008a. The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature 452, 230-234.
- Bluemlein et al. 2011a. No evidence for a shift in pyruvate kinase PKM1 to PKM2 expression during tumorigenesis. Oncotarget 2, 393-400.
- Berg et al. Biochemistry: 使っているのは 6 版ですが 7 版を紹介しています。