Forkhead box transcription factor O (Foxo)
- 概要: Foxoとは
- リン酸化による制御
- アセチル化による制御
- 標的遺伝子
- 寿命との関係(別ページ)
- 分子系統
概要
Forkhead family
> Forkhead domainをもつ転写因子の一群(2I)。
> Forkhead familyはQまでの17のサブファミリーから成り,Aに対してB, C, D, ...の順に相同性が高い(1)。
> ヒト遺伝子はFOXOのように全て大文字で,マウスはFoxoのように,他の生物はFoxOのように表す(1)。
Foxo family
> 哺乳類にはFoxo1, Foxo3a, Foxo4, Foxo6の4種類がある(1,9)。
: Foxo1 = FKHR (Forkhead in human rhabdomisarcoma), Foxo3a = FKHR-L1, Foxo4 = AFX.
: 哺乳類のFOXO3aが,C. elegans DAF-16 およびDrosophilaのdFOXOに相当する(7I)。
: Foxo6 は Akt によるリン酸化サイトを欠き,特殊な細胞内局在を示す(11)。
> マウス Foxo1, 3a, 4 の mRNA の分布はノーザンブロットで調べられている(13)。
: ほぼ全ての組織で検出され,肝臓で発現が低く,白色脂肪組織で高めなどの共通点がある。
: この論文では,Foxo結合配列がTTGTTTACという配列を共通して持っていることも示されている。
> 横紋筋肉腫 (rhabdomyosarcoma) の原因遺伝子として,Pax3 との融合遺伝子の形で同定。
リン酸化による制御
Akt/PKBによるリン酸化
概要
> Foxo1, 3a, 4はいずれもAkt/PKBによってリン酸化され,転写活性を失う(10I)。
マウスFoxo1
> マウス肝細胞で,インスリン刺激によってThr24, Ser253, Ser316でリン酸化される(4R)。
: Ser253に変異を入れると,インスリンによるリン酸化が完全に阻害される。
: 他の2残基では,部分的なリン酸化は起こる。Ser253がgatekeeperである。
: インスリン依存的なリン酸化はwortmanninで阻害されるため,PI3K経路を通じたものである。
> マウス肝細胞では,Ser253がリン酸化されることで他の2つの残基がprimingされる(5R)。
> Thr24はインスリン刺激でリン酸化されるが,IGF-I刺激ではリン酸化されない(5R)。
> IGF-I刺激ではFoxo1は核外に出ず,Thr24のリン酸化が局在を制御していると思われる(5R)。
SGKによるリン酸化
JNKによるリン酸化
アセチル化による制御
概要
> CBP [cAMP-response element-binding protein (CREB)-binding protein] とSir2による制御がある(8)。
: CBP(アセチル化酵素でもある)によってFoxo1とFoxo4がアセチル化されると転写活性が低下(8I)。
: Sir2はFoxo1を脱アセチル化し,転写活性を回復させる(8I)。細胞のストレス耐性が上がる傾向。
> 酸化ストレスによってもリジン残基がアセチル化され,核へ移行する(12I)。
文献8より転載。
アセチル化によってDNAとの結合能が低下する。
DNAと結合しているFoxoはAkt/PKBによるリン酸化を受けにくいため,アセチル化によってFoxoはリン酸化阻害を受けやすくなる。

Sir2 (SIRT1) による制御の詳細
> 哺乳類ではSIRT1が酵母のSir2に最も近く,FOXOとの関連が詳しく調べられている(12)。
: SIRT1は,酸化ストレス条件下でFOXO3と結合して脱アセチル化する。vitroでもvivoでも。
: 脱アセチル化は,全体にFOXOによってストレス耐性が獲得される方向に作用する。
: 例えばp27の発現が上がって細胞周期が止まり,BIMが下がってアポトーシスが抑制されるなど。
結合タンパク質
標的遺伝子
細胞周期に関連する遺伝子
p27 (kip1)
> Foxo4を過剰発現するとp27の発現が増大し,細胞周期が止まる(10R)。MEF,A14などの細胞で実験。
IGFBP-1
> IGF binding protein 1のプロモーター領域にあるinsulin-responsive elementに結合する(13I)。
脂肪細胞分化との関係
ノックアウトマウス
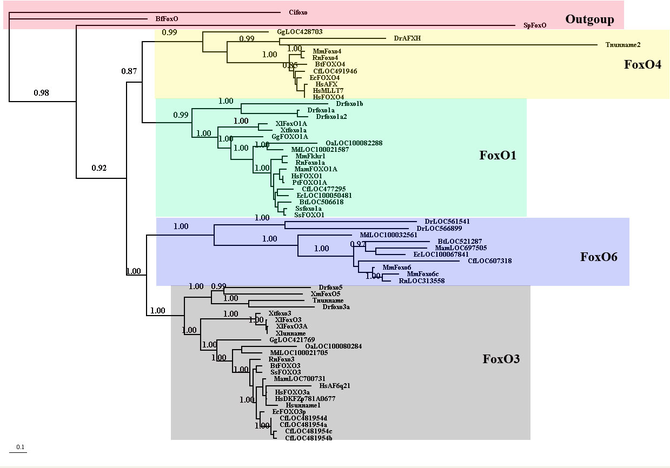
分子系統
> 文献3より転載。Foxo6はbranchが長く,他の分子よりも分子進化が早いことがわかる(3)。
References
- 三浦直行 2004a (Review). 発生・代謝遺伝子として注目を浴びるフォークヘッド遺伝子. 蛋白質核酸酵素 49, 2558-2570.
- Biggs et al. 1999a. Proc Natl Acad Sci USA 96, 7421-7426.
- Wang et al. 2009a. BMC Evol Biol 9, 222.
- Nakae et al. 1999a. J Biol Chem 274, 15982-15985.
- Nakae et al. 2000a. Differential regulation of gene expression by insulin and IGF-I receptors correlates with phosphorylation of a single amino acid residue in the forkhead transcription factor FKHR. EMBO J 19, 989-996.
- Giannakou 2004a. Long-lived Drosophila with over-expressed dFOXO in adult fat body. Science 305, 361.
- Hwangbo 2004a. Drosophila dFOXO controls lifespan and regulated insulin signaling in brain and fat body. Nature 429, 562-567.
- Matsuzaki et al. 2005a. Acetylation of Foxo1 alters its DNA-binding ability and sensitivity to phosphorylation. Proc Natl Acad Sci USA 102, 11278-11283.
- Lam et al. 2013a (Review). Forkhead box proteins: tuning forks for transcriptional harmony. Nat Rev Cancer 13, 482-495.
- Medema et al. 2000a. AFX-like transcription factors mediate cell-cycle regulation by Ras and PKB through p27kip1. Nature 404, 782-787.
- Accili and Arden 2004a (Review). FoxO as the crossroads of cellular metabolism, differentiation, and transformation. Cell 117, 421-426.
- Brunet et al. 2004a. Stress-dependent regulation of FOXO transcription factor by the SIRT1 deacetylase. Science 303, 2011-2015.
- Furuyama et al. 2000a. Identification of the different distribution of mRNAs and consensus binding sequences for mouse DAF-16 homologues. Biochem J 349, 629-634.