アミロイド β と その前駆体タンパク質 (APP)
10-30-2016 updated
- APP 遺伝子の変異とアルツハイマー病
- APP からの切り出しと蓄積
- 細胞外への Aβ 蓄積
- 細胞内への Aβ 蓄積
- APP の本来の機能
- その他
関連項目
- アルツハイマー病
- アルツハイマー病の診断と治療
- てんかん: Epilepsy
- 統合失調症: Schizophrenia
APP 遺伝子の変異とアルツハイマー病
> アルツハイマー病(AD)患者の脳には,約 40 残基のペプチドである amyloid beta (Aβ) が蓄積する(1)。
> これは AD の原因としてもっとも有力であるが,蓄積機構などはあまりわかっていない(1)。
> Aβ の蓄積量と認知症の程度にも,相関がない/あるの両方の報告があり,まだまだ未知の部分が多い(1)。
APP がアルツハイマー病の原因であることの最も有力な証拠は,この遺伝子の変異でADが生じやすいことである(1)。しかし,Aβ の蓄積が具体的にどのように AD の症状を生み出すのかについては未だ不明な点が多い。
> AD と関連した 32 の変異がみつかっており,多くが Aβ42 を生じやすい位置に入っている。
コピー数の変異
> APPは 21 番染色体に乗っており,ダウン症で AD 発症率が高い一因とも考えられている(1)。
> APP 遺伝子のコピー数が増えるような変異は,AD の早期発症を引き起こす(4)。
A673T
> Aβ 量が減り,AD ではない認知症に対してprotectiveに働く(4)。
APPからの切り出しと蓄積
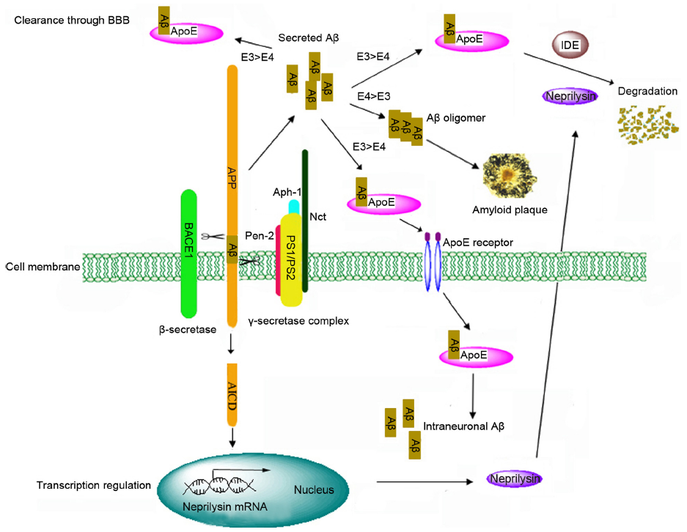
図は文献 4 より転載。APP から Aβ が生じる機構の概要は以下の通りである(4)。
- APP は細胞膜貫通型の糖タンパク質で,プロテアーゼによる分解を受ける。
- 分解は α 経路と β 経路に分けられ,β 経路が amyloid β を生み出す経路である。
- β経路では,β-セクレターゼによって APP が切られ,C 末端側の 99 アミノ酸から成る断片(C99)が膜に残る。
- C99 は γ-セクレターゼによって 38 - 43 アミノ酸のペプチドになり,N 末端側の Aβ が細胞外へ分泌される。
- 残りの部分は AICD(APP intracellular C-terminal domain)と呼ばれ,核へ移行して neprilysin の転写を促進。
- 通常,γ-secretase は40アミノ酸から成る Aβ40 を生み出すが,同時に毒性の高い Aβ42 も作る。
細胞外への Aβ 蓄積
> 前頭葉 PFC,頭頂葉,後部帯状回から楔前部の皮質に多く蓄積し,小脳 cerebellum 皮質には少ない(5)。
> 成分 (1): Aβ, glycosaminoglycan, serum amyloid P component, apolipoprotein E, collagen etc.
> Cu, Zn, Feなどの金属が1 mMの高濃度で含まれる(1)。
> 逆に,金属イオンの多い場所でプラークができやすいという報告もある(1)。
> Amyloid plaqueの形成には,nucleation, growth, stationaryの3つのphaseがある(1)。
: 律速段階は,プラークの核ができる nucleation だが,金属イオンは核の形成を助ける作用がある。
> Senile, diffuse, cerebrovascular の3種類がある(1)。
: Diffuse plaque は直径20 µm以下で,プラーク形成の初期段階にあると考えられる。
: Senile plaque は直径50 - 200 µmで,神経突起の周辺を取囲むように存在する。
アルツハイマー病との関係
> AD model である Tg2576 mice では,Aβ 蓄積よりも早く神経の減少などの症状が現れる(4)。
細胞内への Aβ 蓄積
従来は,Aβ は細胞外に蓄積すると考えられてきたが,細胞内にも蓄積することが明らかになっている(4)。細胞外にの Aβ 蓄積の影響も無視できないが,可溶性 Aβ と細胞内 Aβ の方が AD の原因として疑わしいというのが最近の傾向である(4)。
APPの本来の機能
APP は Aβ 産生以外に本来の機能をもっているが,本来の機能はそれほど詳しくわかっているわけではない。多くの場合,分解されてそれぞれの断片が機能することも,このタンパク質の役割を複雑にしている要因である(7)。
> 分解前は受容体で,G-protein を介したシグナル伝達を仲介する(7)。
: ヘパリン,ラミニンなど細胞外分子と結合する。細胞接着に機能しているかもしれない。
> 過剰発現およびノックアウトにより,シナプス可塑性,記憶 memory などに重要であることがわかっている。
: APP KO mice show deficits in structure and function in neuromuscular synapses (4).
: APP transgenic mice は,シナプス可塑性や記憶力が上昇する(4)。
> APP は cyclin-dependent kinase 5 (Cdk5) の過剰活性化を阻害し,Tau の過剰リン酸化を抑制する(4)。
その他
> 海馬 hippocampus の細胞培養液に,5 µM Aβ1-42 を加えると細胞死が誘導される(3R)。
: 2.5 µM では,8時間後にも細胞死はみられなかった。
: β-ヒドロキシ酢酸を 4 mM 程度培地に加えることで,細胞死が抑制される。
> Neuroblastoma cell に15 µM Aβ1-42 を加えると,24 hで32%しか生細胞が残らなかった(6R)。
: LPBNAH という抗酸化物質で生存率が上がったため,この毒性は活性酸素によると思われる。
> Aβ による活性酸素毒性は,ミトコンドリアが起源と考えられている(6D)。
: ミトコンドリアのない細胞には,Aβ は毒性を示さない。
References
- Tiiman 2013a (Review). The missing link in the amyloid cascade of Alzheimer’s diseare - metal ions Neurochem Int 62, 367-378.
- Gotz 2008a (Review). Animal models of Alzheimer's disease and frontotemporal dimentia. Nat Rev Neurosci 9, 532-544.
- Kashiwaya 2000a. D-β-hydroxybutyrate protects neurons in models of Alzheimer's and Parkinson's disease. PNAS 97, 5440-5444.
- Dong et al. 2012a (Review). Advances in the pathogenesis of Alzheimer's disease: a re-evaluation of amyloid cascade hypothesis. Transl Neurodegener 1, 18.
- Pittsburgh Compound-B(PIB)を用いたPETによるアルツハイマー型認知症研究. Link.
- Poeggeler et al. 2005a. Mitochondrial medicine: neuroprotection and life extension by the new amphiphilic nitrone LPBNAH1 acting as a highly potent antioxidant agent. J Neurochem 95, 962-973.
- アミロイド β 前駆体タンパク質. PDBj 今月の分子. Link.