アミノ酸 amino acid の目次
2018/02/11 Last update
このページは アミノ酸の概要と目次 @本家UBサイト に恒久的に移転しました。このページもネット上に残っていますが、最新の情報はリンク先を参照して下さい。
- 概要: アミノ酸とは
- 覚え方いろいろ
- タンパク質構成アミノ酸
-
構造によるタンパク質構成アミノ酸の分類
- 芳香族アミノ酸
- 分岐鎖アミノ酸
-
極性および等電点による分類
- 極性,非極性アミノ酸
- 酸性,塩基性アミノ酸
- 荷電アミノ酸 -> 酸性,塩基性アミノ酸
- 分解による分類
- アミノ酸分解の基礎
- 糖原性アミノ酸
- ケト原性アミノ酸
概要: アミノ酸とは
アミノ酸 amino acid は,広義には アミノ基 -NH2 とカルボキシル基 -COOH の両方をもつ有機化合物の総称 である(2)。
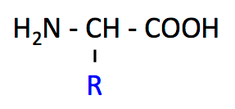
狭義には,タンパク質 protein の構成成分である α-アミノ酸を指す。α-アミノ酸の構造は右の図のように一般化される。すなわち,
- カルボキシル基が結合している炭素(これを α 炭素という)にアミノ基も結合している。
- α 炭素に様々な側鎖(R,このページで青字で示す部分)が結合しており,側鎖によってアミノ酸の性質が決まる。
- アミノ酸には,光学異性体の D 型 と L 型がある。一般にタンパク質を構成するのは L 型のアミノ酸である。しかし,これを説明する合理的な理由は不明である。
アミノ酸の一般式
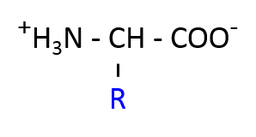
生体内での電離状況
アミノ酸の電離と pH
ページの下にアミノ酸の構造の一覧があり,それぞれの官能基の pKa を合わせて示してある。全体として言えることは,COOH 基の pKa は低く,NH3+ の pKa は高いということである。つまり,COOH の部分は強い酸であり電離しやすい。一方,NH3+ は弱い酸で,電離しにくいということだ。
- 生理的 pH (中性, pH = 7 付近) では,カルボキシル基は COO- に,アミノ基は NH3+ になっている。この状態を dipolar form (dipolar ion) という。
- なお,pH < 4.0 ぐらいから COOH を,pH > 8 ぐらいから NH2 を含むアミノ酸が増えてくる(2)。
pKa は,アミノ酸の機能に関わる 非常に重要な概念 である。
これを身につけると,たとえば酵素の活性中心になぜヒスチジン His が位置することが多いのかが理解できるようになる。
右に pKa を理解するための一連のページを示したので,参考にしてもらいたい。番号順に読むとわかりやすいはずである。
覚え方いろいろ
タンパク質構成アミノ酸
Ala, alanine, A, アラニン
- 乳酸 lactate とともに肝臓での糖新生 gluconeogenesis の主な原料。
- 解糖系 glycolysis の最終産物ピルビン酸 pyruvate から合成される。
- 解糖の最終酵素ピルビン酸キナーゼ PK に結合し,活性を阻害する。
- アミノ酸分解の際,肝臓へ窒素を輸送する働きをする。
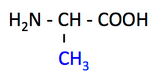
pK1 (COOH) = 2.4
pK2 (NH3+) = 9.9
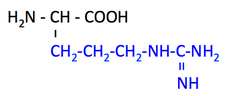
pK1 (COOH) = 1.8
pK2 (NH3+) = 9.0
pK3 (側鎖) = 12.5
Asn, asparagine, N, アスパラギン
- アスパラガスから最初に単離されたためこの名がついた。
- 必須アミノ酸ではなく,TCA 回路の中間体から生合成される。
- 側鎖がポリペプチド骨格と水素結合を形成できるため,α-helix の始点および終点,β-シートのターンの部分などに位置する。
- N-linked glycosylation を受ける。
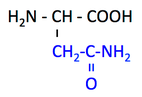
pK1 (COOH) = 2.1
pK2 (NH3+) = 8.8
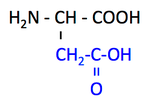
pK1 (COOH) = 2.1
pK2 (NH3+) = 9.9
pK3 (側鎖) = 3.9
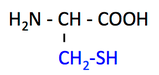
pK1 (COOH) = 1.9
pK2 (NH3+) = 10.8
pK3 (側鎖) = 8.3
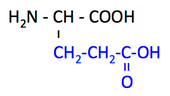
pK1 (COOH) = 2.1
pK2 (NH3+) = 9.5
pK3 (側鎖) = 4.1
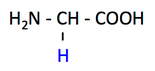
pK1 (COOH) = 2.4
pK2 (NH3+) = 9.8
His, histidine, H, ヒスチジン [histidiːn]
- 側鎖にイミダゾイル基をもつタンパク質構成アミノ酸はこれだけ。酸にも塩基にもなれるという特殊なアミノ酸である。
- イミダゾール環の N がプロトンを受け取れる。つまり塩基である。これによって正に荷電することができる。
- 酵素の活性中心になることが多い。これはイミダゾール環がプロトンと結合する pKa が 6 前後で,局所的な条件によってプロトンを自由に扱えるためである。
- 金属イオンと配位結合を形成することができる。これは,イミダゾール環の水素と結合していない方の N が電子対をもっているためである。
- ヒスタミン,カルノシン生合成の前駆体。
- 大腸菌発現系で,6 x His がタグとしてよく用いられる。
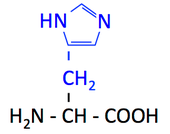
pK1 (COOH) = 1.8
pK2 (NH3+) = 9.3
pK3 (側鎖) = 6.0
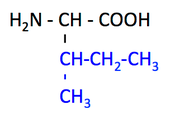
pK1 (COOH) = 2.3
pK2 (NH3+) = 9.8
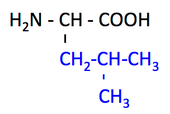
pK1 (COOH) = 2.3
pK2 (NH3+) = 9.7
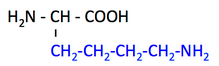
pK1 (COOH) = 2.2
pK2 (NH3+) = 9.2
pK3 (側鎖) = 10.8
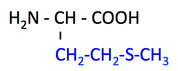
pK1 (COOH) = 2.1
pK2 (NH3+) = 9.3
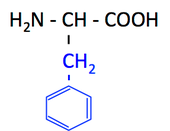
pK1 (COOH) = 2.2
pK2 (NH3+) = 9.2
Pro, proline, P, プロリン
- アミノ基 NH2 を持たず,厳密にはアミノ酸ではない。
- 環状構造がタンパク質の構造に大きく影響する。例えば,Pro が含まれていると α-helix 構造が不安定になる。

*7/15/2016 構造を修正
pK1 (COOH) = 2.0
pK2 (NH3+) = 10.6
Ser, serine, S, セリン
- OH 基でリン酸化される。
- プロテアーゼなどの酵素 enzyme の活性中心になれる。OH 基が O- となって求核攻撃ができるため。Chymotrypsin のページに詳細。
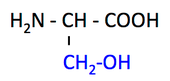
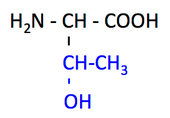
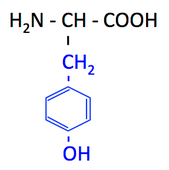
pK1 (COOH) = 2.1
pK2 (NH3+) = 9.1
pK3 (側鎖) = 約 13
pK1 (COOH) = 2.1
pK2 (NH3+) = 9.1
pK3 (側鎖) = 10.1
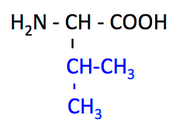
pK1 (COOH) = 2.2
pK2 (NH3+) = 9.7
その他のアミノ酸および関連化合物
Tau, taurine, タウリン
生体で重要な働きを示す分子で,アミノ酸のように扱われているが,カルボキシル基 carboxyl group をもたないためアミノ酸ではない。イカ,タコ,カキ,アサリなどに多く含まれる。
NAA, N-Acetyl-L-aspartate, N-アセチルアスパラギン酸
Glu の次に高い濃度で脳 brain に存在する遊離アミノ酸。神経 neuron で作られ,軸索から細胞外液へ流出する。浸透圧調節や Asp の前駆体として機能していると思われる。脳で神経細胞数のマーカーとして使われる。
β-N-methylamino-L-alanine, L-BMAA
ソテツ類に含まれる神経毒性をもつアミノ酸(Kisby, 2013a)。

